Preclinical evaluation of safety and immunogenicity of a primary series intranasal COVID-19 vaccine candidate (BBV154), and humoral immunogenicity evaluation of a heterologous prime-boost strategy with COVAXIN (BBV152)
Krishna vadrevu ( kmohan@bharatbiotech.com ) Bharat Biotech International Ltd, Hyderabad, India
Posted Date: September 13th, 2022
DOI: https://doi.org/10.21203/rs.3.rs-1994688/v1
Preclinical evaluation of safety and immunogenicity of a primary series intranasal COVID-19 vaccine candidate (BBV154), and humoral immunogenicity evaluation of a heterologous prime-boost strategy with COVAXIN (BBV152)
Abstract
Most if not all vaccine candidates developed to combat COVID-19 due to SARS-CoV-2 infection are administered parenterally. As SARS-CoV-2 is transmitted through infectious respiratory uids, vaccine- induced mucosal immunity could provide an important contribution to control this pandemic. ChAd- SARS-CoV-2-S (BBV154), a replication-defective chimpanzee adenovirus (ChAd)-vectored intranasal (IN) COVID-19 vaccine candidate, encodes a prefusion-stabilized version of the SARS-CoV-2 spike protein containing two proline substitutions in the S2 subunit. We performed preclinical evaluations of BBV154 in mice, rats, hamsters and rabbits. Repeated dose toxicity studies presented excellent safety proles in terms of pathology and biochemical analysis. IN administration of BBV154 elicited robust mucosal and systemic humoral immune responses coupled with cell-mediated immune responses dominated by Th1- like cytokine expression. Heterologous prime-boost vaccination with intramuscular (IM) COVAXIN-prime followed by BBV154 intranasal in rabbits elicited superior immune responses compared with the homologous COVAXIN/COVAXIN schedule. BBV154 is now being assessed in both homologous and heterologous combination schedules in ongoing human clinical trials.
COVID-19経鼻ワクチン候補(BBV154)の安全性および免疫原性の前臨床評価、ならびにCOVAXIN(BBV152)を用いた異種混合プライムブースト戦略の液性免疫原性評価
要旨
SARS-CoV-2感染によるCOVID-19対策として開発されたワクチン候補のほとんどは,非経口投与されている。SARS-CoV-2は呼吸器感染症であるため、ワクチンによる粘膜免疫の誘導は、このパンデミックの抑制に重要な貢献をする可能性がある。ChAd-SARS-CoV-2-S(BBV154)は、チンパンジーアデノウイルス(ChAd)を用いたCOVID-19経鼻ワクチン候補で、SARS-CoV-2のS2サブユニットのプロリン2置換を含む前駆安定化型スパイク蛋白をコードしています。BBV154の前臨床評価をマウス、ラット、ハムスター、ウサギで実施しました。反復投与毒性試験では、病理学的および生化学的解析の観点から、優れた安全性プロルを示した。BBV154のIN投与により、粘膜および全身の液性免疫反応と、Th1様サイトカイン発現が支配的な細胞性免疫反応が誘発された。ウサギにCOVAXIN-primeを筋肉内投与した後にBBV154を鼻腔内投与する異種混合prime-boostワクチン療法は、COVAXIN/COVAXINの同種のスケジュールと比較して優れた免疫応答を引き起こした。BBV154は、現在進行中のヒト臨床試験において、同種および異種の組み合わせのスケジュールで評価されています
Results
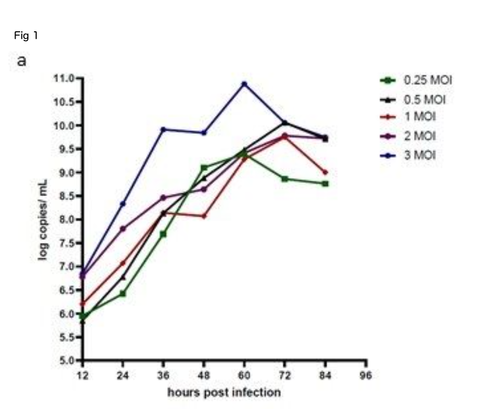
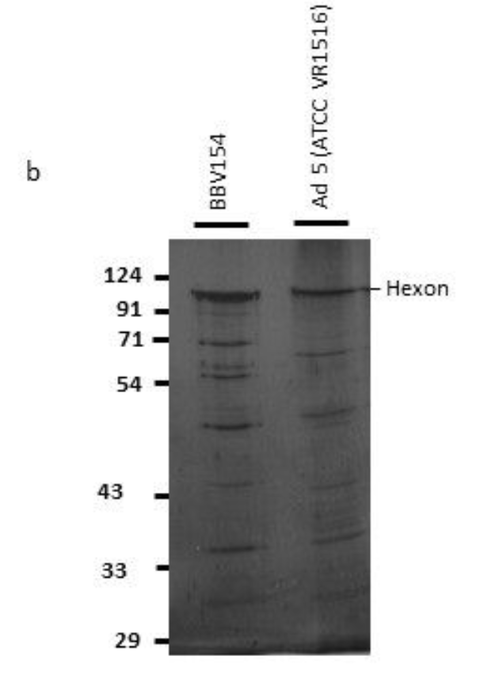
Production of BBV154. The master and working virus banks of the BBV154 vaccine and the HEK cells were prepared in a GMP facility. Virus and cell banks were characterized for identity, safety and purity according to ICH guidelines. Infection of the HEK cells with the BBV154 produced a cytopathic effect (CPE) which included rounding of cells and lysis. Growth kinetics of the BBV154 in HEK cells was carried out with ve different multiplicities of infection (MOI) ranging from 0.25 to 3 MOI. Based on the results of ChAd genome copies (Fig. 1a) and infectious titer (data not shown) estimations of the growth kinetics sample, an optimum MOI of 1 and a harvest time between 60–72 hours were selected. The downstream purication cascade as mentioned in the Methods section was followed to obtain a puried and formulated BBV154 vaccine candidate (Fig. 1b).
BBV154の製造 BBV154ワクチンのマスターウイルスバンクとワーキングウイルスバンク、およびHEK細胞は、GMP施設で調製されました。ウイルスと細胞バンクは、ICHガイドラインに従って、同一性、安全性、純度の評価を行いました。HEK細胞にBBV154を感染させると、細胞の丸みと溶解を含む細胞病理効果(CPE)が生じた。BBV154のHEK細胞における増殖動態は、0.25から3MOIの範囲で異なる感染倍率(MOI)で実施された。増殖動態サンプルのChAdゲノムコピー数(図1a)および感染価(データ示さず)の推定結果に基づいて、最適なMOIである1と60~72時間の間の収穫時間を選択した。方法」のセクションで述べた下流の精製カスケードに従って、精製・製剤化されたBBV154ワクチン候補を得た(図1b)
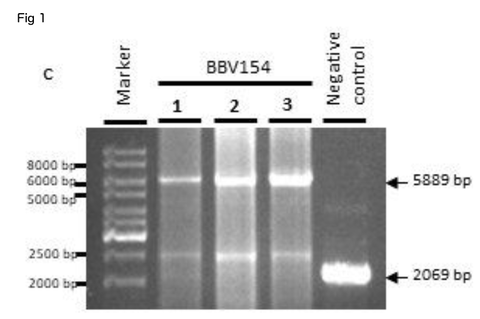
Characterization of BBV154. The BBV154 vaccine candidate was tested for the integrity of the expression cassette by conventional PCR. The primers anking the expression cassette were used to amplify an expected product of 5889 base pairs (bp) from three different batches. A PCR product of 2069 bp was obtained with the ChAd vector control (Fig. 1c).
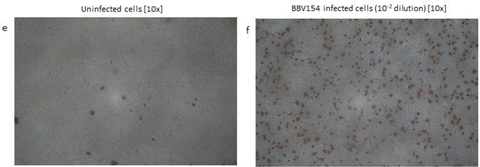
The spike expression by BBV154 was accessed by infection of HEK cells and the cell lysates were subjected to western blotting with antibody against the receptor binding domain (RBD) of spike protein (Fig. 1d). The RBD antibody detected the full-length spike in the cell lysates derived from BBV154 infected cells (Fig. 1d, lanes 2–4) and the spike protein size corresponds to that of the positive control (Fig. 1d, lane 5). The spike expression of BBV154 was also demonstrated by immunocytochemistry, spike expression products being visualized as distinct spots (Fig. 1e and 1f).
BBV154の特性評価 BBV154ワクチン候補は、従来のPCRによって発現カセットの完全性をテストされた。発現カセットを示すプライマーを用いて、3つの異なるバッチから5889塩基対(bp)の予想産物を増幅させた。ChAdベクターコントロールでは、2069bpのPCR産物が得られた(図1c)
BBV154によるスパイクの発現をHEK細胞への感染によりアクセスし、細胞溶解液をスパイクタンパク質の受容体結合ドメイン(RBD)に対する抗体によるウェスタンブロッティングに供した(図1d)。RBD抗体は、BBV154感染細胞由来の細胞ライセートにおいて全長スパイクを検出し(図1d、レーン2-4)、スパイクタンパク質のサイズは陽性対照のものと一致した(図1d、レーン5)
BBV154のスパイク発現は、免疫細胞化学によっても証明され、スパイク発現産物は明瞭なスポットとして可視化された(図1eおよび1f)
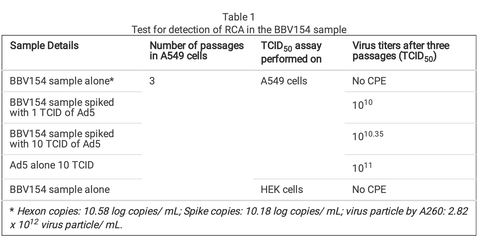
In order to test for the presence of replication competent adenovirus (RCA), BBV154 was passaged in A549 cells that do not have complement E1. As expected, CPE was not observed even after three consecutive passages indicating absence of RCA. To exclude the possibility of inhibition of the RCA in the BBV154 sample, BBV154 spiked with wild type Ad5 (1 or 10 TCID) displayed CPE with an amplication between 109 to 1010 TCID50 (Table 1).
複製能のあるアデノウイルス(RCA)の存在を確認するため、BBV154を補体E1を持たないA549細胞で継代した。予想通り、3回継代してもCPEは観察されず、RCAが存在しないことが示された。BBV154のRCA阻害の可能性を排除するため、BBV154に野生型Ad5(1または10 TCID)を添加したところ、109から1010 TCID50の間で増幅しCPEを示した(Table 1)
Table 1. Test for detection of RCA in the BBV154 sample
表1 BBV154サンプルにおけるRCA検出のためのテスト
Safety evaluation of BBV154 formulation. An extensive safety evaluation for the vaccine candidate BBV154 formulation was performed as per the regulatory guidelines20,21. Safety of BBV154 was assessed by repeated dose toxicity studies conducted in both rodent (Swiss albino mice, BALB/c mice and Wistar rats) and non-rodent (New Zealand White rabbits) species, after the administration of N + 1 dose regimen. No mortality, systemic toxicity or clinical signs was observed in any of the animal models throughout the tested experimental period. Body weight gain (Supplementary Fig. 1), food consumption and body temperature of the animals were within the normal range. Clinical chemistry parameters such as hematology, clinical biochemistry, urinalysis, coagulation analysis and acute phase protein values did not indicate any variation in the vaccine-treated animals from placebo-treated animals even at the highest dose tested (5 x 1011 VP/animal). Further, the coagulation factors leading to thrombosis or thrombocytopenia, platelet count, prothrombin time and activated partial thromboplastin time (APTT) were well within the normal range and comparable with the concurrent control group and were unaffected by BBV 154 (Supplementary Tables 2 & 3).
BBV154製剤の安全性評価 ワクチン候補であるBBV154製剤の広範な安全性評価は、規制ガイドライン20,21に従って実施されました。BBV154の安全性は、げっ歯類(スイスアルビノマウス、BALB/cマウス、ウィスターラット)および非げっ歯類(ニュージーランド白ウサギ)にN+1投与法を実施した反復投与毒性試験により評価されました。また,いずれの動物モデルにおいても,試験期間中,死亡率,全身毒性および臨床症状は観察されなかった。体重増加率(補足図1),摂餌量および体温は正常範囲内であった
suppl doxs
血液学、臨床生化学、尿検査、凝固分析、急性期タンパク質値などの臨床化学パラメータは、試験した最高用量(5×1011 VP/匹)でも、ワクチン投与動物とプラセボ投与動物でいかなる変化も示さなかった。さらに、血栓症や血小板減少症につながる凝固因子、血小板数、プロトロンビン時間、活性化部分トロンボプラスチン時間(APTT)は、正常範囲内で、同時対照群と同等であり、BBV154の影響を受けなかった(補足表2および3)
The skin around the nose did not show any local reactogenicity such as erythema, edema or eschar formation on gross observation. Absolute and relative (to body weight) organ weights were comparable to placebo animals. Further extensive histopathological evaluation, following Registry of Industrial Toxicology Animal-data (RITA) guidance, of three levels of nasal cavity (Supplementary Fig. 2) and related organs such as larynx, trachea, lungs or associated lymph nodes (Supplementary Fig. 3) did not reveal any abnormalities in microscopic observations. Immunogenicity of single dose vaccination of BBV154. Immunogenicity of BBV154 candidate vaccine was evaluated in both inbred (BALB/c) and outbred (Swiss albino) mice. Humoral and cellular immune responses were assessed in mice two-weeks post vaccination with either one-tenth, one quarter or half (1x1010, 2.5x1010 or 5x1010 VP respectively) of a human single dose (HSD). Single dose vaccination of BBV154 elicited systemic and mucosal immune response against SARS-CoV-2 spike as early as 14 days post vaccination (Supplementary Fig. 4a).
鼻周囲の皮膚は,肉眼観察では紅斑,浮腫,糜爛などの局所的な反応性を認めなかった。臓器の絶対量および相対量(体重に対する)はプラセボと同程度であった。さらに、Registry of Industrial Toxicology Animal-data (RITA)のガイダンスに従って、鼻腔3層(補足図2)および喉頭、気管、肺、関連リンパ節などの関連臓器(補足図3)の病理組織学的評価を行ったが、顕微鏡観察で異常は認められなかった。BBV154の単回接種の免疫原性 BBV154候補ワクチンの免疫原性を近交系マウス(BALB/c)および外来系マウス(Swiss albino)の両方で評価した。ヒトの単回投与量(HSD)の10分の1、4分の1、半分(それぞれ1x1010、2.5x1010、5x1010 VP)を接種して2週間後のマウスで、体液性および細胞性免疫応答を評価した。BBV154の単回ワクチン接種は、ワクチン接種後14日目という早い段階でSARS-CoV-2スパイクに対する全身および粘膜免疫応答を惹起した(補足図4a)
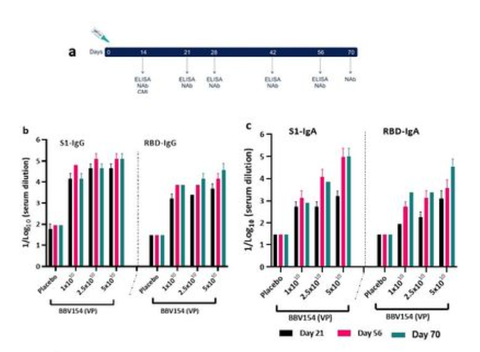
On day 21 after vaccination, signicant spike-specic systemic IgG and IgA responses were detected in most of the vaccinated animals, with comparable spike-specic IgG immune responses in BALB/c and Swiss Albino sera (Supplementary Fig. 4b). Mice vaccinated with 5 × 1010 VP had higher spike-specic antibody titers than those given 1×1010 VP, demonstrating a dose- dependent response (Fig. 2b & 2c). Additionally, substantial increases in serum IgG and IgA levels were observed on day 56 compared with day 21. Spike-specic antibodies were persistent and still measurable on day 70, ten weeks after vaccination, demonstrating durable immunity. IN immunization is known to stimulate mucosal IgA antibodies, providing a rst line of defence against respiratory pathogens, and IN vaccination with BBV154 induced S1-specic IgG and IgA responses in the bronchoalveolar lavage (BAL) uids (Fig. 2e). As with the systemic IgG and IgA, dose-dependent pulmonary antibody responses were observed.
ワクチン接種後21日目に、ほとんどのワクチン接種動物で有意なスパイク特異的全身性IgGおよびIgA反応が検出され、BALB/cおよびスイスアルビノの血清では同等のスパイク特異的IgG免疫反応が見られた(補足図4b)。5×1010 VPを接種したマウスは、1×1010 VPを接種したマウスよりも高いスパイク特異的抗体価を示し、用量依存的な反応を示した(図2bおよび図2c)
さらに、血清IgGおよびIgAレベルの実質的な上昇は、21日目と比較して56日目に観察された。スパイク特異的な抗体は持続的で、ワクチン接種から10週間後の70日目にも測定可能であり、耐久性のある免疫であることが示された。また、BBV154の接種により、気管支肺胞洗浄液中にS1特異的IgGおよびIgA応答が認められた(図2e)。全身性のIgGおよびIgAと同様に、用量依存的な肺の抗体反応が観察された
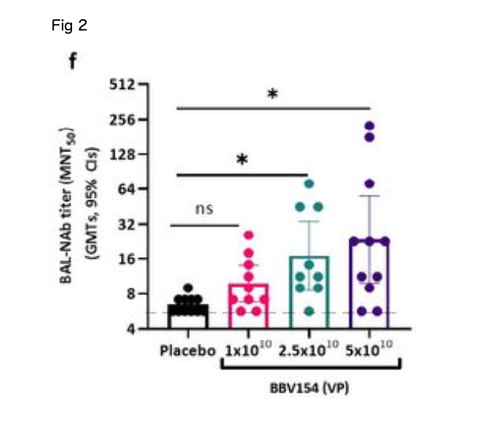
Vaccine-induced neutralizing antibody responses against SARS-CoV-2 NIV-2020-770 (containing the D614G mutation)22 were assessed using a live virus microneutralization test (MNT50). Consistent with the spike-specic antibody responses, immune sera from BBV154 vaccinated mice neutralized SARS- CoV-2. Responses were dose-dependent: mice vaccinated with 5×1010 VP had higher neutralizing antibody titers (GMT = 264), than those given 2.5×1010 VP (GMT = 76) which in turn were higher than those given 1×1010 VP (GMT = 45) (Fig. 2e). Notably, these neutralizing antibody GMTs remained unchanged even after 56 days post vaccination. Further, the assessment of SARS-CoV-2 neutralizing antibodies in bronchoalveolar lavage (BAL) uid of BBV154 immunized mice also displayed SARS-CoV-2 neutralizing antibodies in dose-dependent manner (Fig. 2f). As expected, neither serum nor BAL uid from placebo-treated mice exhibited any SARS-CoV-2 neutralizing activity. Further, the level of the neutralizing antibody response was well-correlated with S1-specic systemic IgG levels quantied in individual animals (Pearson r2 = 0.7504, Fig. 2g), signifying that robust antibody responses to spike protein were allied with generation of potentially protective neutralizing antibodies.
SARS-CoV-2 NIV-2020-770 (D614G変異を含む)22に対するワクチン誘発中和抗体反応を、ライブウイルス微量中和試験(MNT50)を用いて評価した。スパイク特異的な抗体反応と同様に、BBV154を接種したマウスの免疫血清は、SARS- CoV-2を中和した。反応は用量依存的であった:5×1010 VPを接種したマウスは、2.5×1010 VPを接種したマウス(GMT = 76)よりも高い中和抗体価(GMT = 264)を示し、さらに1×1010 VP(GMT = 45)よりも高かった(図2e). 注目すべきは、これらの中和抗体のGMTはワクチン接種後56日経過した後も変化していないことである。さらに、BBV154免疫マウスの気管支肺胞洗浄液(BAL)中のSARS-CoV-2中和抗体の評価も、用量依存的にSARS-CoV-2中和抗体を示した(図2f)
プラセボマウスの血清およびBAL液は、予想通りSARS-CoV-2中和活性を全く示さなかった。さらに、中和抗体のレベルは、個々の動物で定量されたS1特異的全身IgGレベルとよく相関しており(Pearson r2 = 0.7504, Fig. 2g)、スパイクタンパク質に対する強固な抗体応答は、潜在的に防御的中和抗体の生成と関連していることが示唆される
Having observed a robust antibody response in vaccinated mice, we next examined the cell mediated immune (CMI) response activated via IN immunization. Ex vivo re-stimulation of splenocytes of vaccinated animals with S1 protein resulted in a signicant induction of Th1 associated IFN-γ or TNF-α cytokines (Fig. 2h). Moreover, T-cells from the BBV154 immune animals produced low levels of IL-10 and IL-4 when compared with T-cells from the placebo-treated mice. This indicates that IN vaccination of BBV154 did not initiate a Th2 response but rather induced the expected antiviral T-cell responses.
次に、IN免疫によって活性化される細胞媒介性免疫(CMI)反応について検討した。S1タンパク質でワクチン接種した動物の脾臓細胞をex vivoで再刺激すると、Th1関連IFN-γまたはTNF-αサイトカインが有意に誘導された(図2h)
さらに、BBV154免疫動物からのT細胞は、プラセボ処理マウスからのT細胞と比較して、低レベルのIL-10及びIL-4を産生した。これは、BBV154のINワクチン接種がTh2応答を開始せず、むしろ期待される抗ウイルスT細胞応答を誘導したことを示す
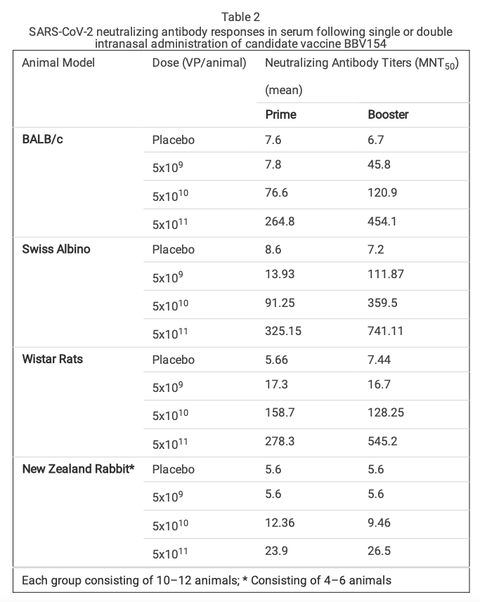
Repeated-dose IN immunization of BBV154 elicits anti-spike humoral response. The immunogenicity and tolerability of clinical batch samples of BBV154 vaccine were evaluated in mice, Wistar rats and New Zealand White rabbits with a full human dose (N + 1) regimen. Repeated doses of different concentrations of candidate vaccine (5x109 VP [low-dose], 5x1010 VP [medium-dose], or 5x1011 VP [high- dose] per animal) were administered IN on days 0, 21 and 28. Serum samples were collected 21 days post-primary or pre-prime booster immunization and spike-specic IgG and IgA responses were evaluated by ELISA. Mice, rats and rabbits immunized with high- and medium-doses of vaccine elicited signicantly higher IgG and IgA responses against puried S1 antigen than in the low-dose group (Fig. 3b-3e). Consistent with the spike binding antibody response, BBV154 vaccination elicited substantial increases in the SARS-CoV-2 specic neutralizing antibodies in mice, rats and rabbits (Fig. 3f & 3g). Notably, boosting enhanced serum neutralization activity two- to four-fold in high-dose group (5x1011 VP) animals, with insignicant increases in rabbit immune sera (Table 2), whereas no neutralizing antibodies were detected in sera from placebo-treated animals after primary immunization or boosting.
BBV154の反復投与IN免疫により、抗スパイク体液性応答が誘発される。BBV154ワクチンの臨床バッチサンプルの免疫原性および忍容性を、マウス、WistarラットおよびNew Zealand Whiteウサギを用い、完全ヒト用量(N + 1)レジメンで評価した。異なる濃度の候補ワクチン(動物あたり5x109 VP[低用量]、5x1010 VP[中用量]、または5x1011 VP[高用量])を0、21、28日目に反復投与した。血清試料を一次免疫後または一次ブースター免疫前の 21 日目に採取し、スパイク特異的 IgG および IgA 応答を ELISA 法で評価した。高用量および中用量のワクチンで免疫したマウス、ラットおよびウサギは、精製したS1抗原に対して、低用量群よりも有意に高いIgGおよびIgA応答を誘発した(図3b~3e)
スパイク結合抗体反応と同様に、BBV154ワクチン接種は、マウス、ラットおよびウサギにおいてSARS-CoV-2特異的中和抗体の大幅な増加を引き起こした(図3fおよび3g)
特に、高用量群(5x1011VP)では、ブースティングにより血清中和活性が2~4倍に上昇し、ウサギの免疫血清ではほとんど上昇しなかったが(表2)、プラセボ投与動物の血清では一次免疫後およびブースト後に中和抗体は検出されなかった。
Table 2 . SARS-CoV-2 neutralizing antibody responses in serum following single or double intranasal administration of candidate vaccine BBV154
表2 . 候補ワクチンBBV154の単回または二回鼻腔内投与後の血清中のSARS-CoV-2中和抗体反応
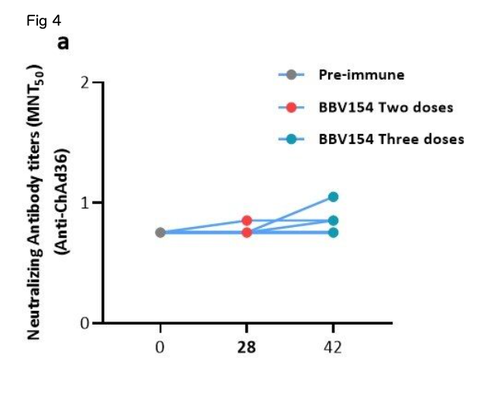
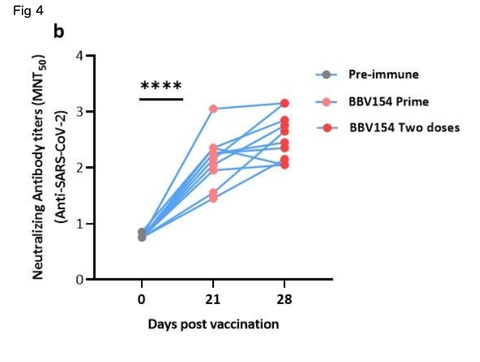
We then assessed the levels of anti-vector (ChAd36)-specic neutralizing antibodies in vaccinated animals. In line with a previous study23, most of the animals did not produce the ChAd36 neutralizing
antibodies, only 3 out of 12 vaccinated rat sera appearing to have low titers of anti-ChAd36 antibodies (Fig. 4a). However, the immune sera derived from the same animals displayed signicantly higher levels of SARS-CoV-2 virus neutralization activity compared with pre-immune sera (Fig. 4b). Absent or insignicant titers of vector (ChAd36)-specic neutralizing antibodies following three doses of BBV154 implies that IN administration may offer an advantage for repeat vaccination using adenovirus-vectored vaccines.
次に、ワクチン接種動物における抗ベクター(ChAd36)特異的な中和抗体のレベルを評価した。以前の研究23と同様に、ほとんどの動物がChAd36中和抗体を産生しなかった
12匹のワクチン接種ラットの血清のうち、わずか3匹が低力価の抗ChAd36抗体を有していたようである(図4a)
しかし、同じ動物に由来する免疫血清は、免疫前の血清と比較して、有意に高いレベルのSARS-CoV-2ウイルス中和活性を示した(Fig. 4b)
BBV154の3回投与後にベクター(ChAd36)特異的な中和抗体の力価がないか、あるいは無視できるほど低いことから、アデノウイルスベクターを用いたワクチンの反復接種にはIN投与が有利であることが示唆される
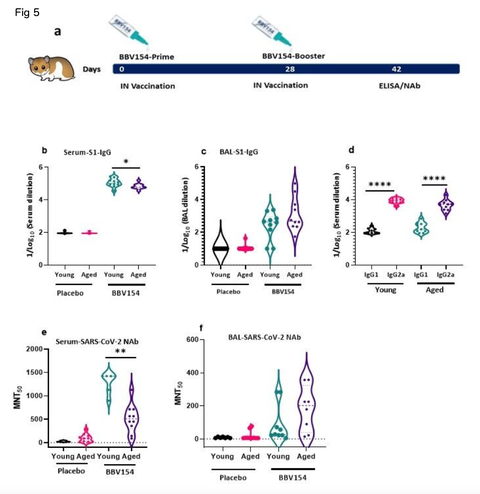
BBV154 immunogenicity in the young and aged hamsters. Aging is accompanied by changes in the immune system, particularly in adaptive immune responses which are diminished in the aged individuals24. We explored age-dependent differences in the immunogenicity of BBV154 candidate vaccine in young (9–11 weeks) or aged (28–36 weeks) Syrian Hamsters. Consistent with earlier preclinical studies by Bricker et al18, following vaccination signicant spike-specic systemic and mucosal IgM and IgG responses were detected in most of the vaccinated hamsters. Further, BBV154- immunized young animals showed a moderate but signicant increase in levels of spike-specic IgG compared with older animals (Fig. 5b), whereas both young and old animals presented comparable mucosal IgG responses (Fig. 5c). BBV154 vaccination in young and old animals elicited a lower IgG1 antibody response than IgG2, indicating Th1 phenotype, with IgG2a/IgG1 ratios greater than 1 (Fig. 5d). Due to non-availability of commercial Anti-hamster-IgA secondary antibodies, IgA responses were not analysed. However, we would anticipate nding the IgA response in hamsters to be similar to other animals that were vaccinated with BBV154. As with spike-specic binding antibodies, BBV154 immune sera from young animals had much higher levels of SARS-CoV-2 neutralizing activity than immune sera from old animals (Fig. 5e). Levels of neutralizing antibodies in saliva were found to be comparable in young and old animals (Fig. 5f).
若齢および高齢のハムスターにおけるBBV154の免疫原性 加齢に伴い、免疫系は変化し、特に適応免疫応答は低下する24。我々は、若齢(9-11週)および高齢(28-36週)のシリアンハムスターにおけるBBV154候補ワクチンの免疫原性の年齢依存的差異を検討した。Brickerらによる先行前臨床研究18と同様に、ワクチン接種後、ほとんどのハムスターで有意なスパイク特異的な全身および粘膜のIgMおよびIgG反応が検出された。さらに、BBV154を接種した若い動物は、高齢の動物と比較してスパイク特異的IgGのレベルが中程度だが有意に増加し(図5b)、一方、若い動物と高齢の動物の両方が同等の粘膜IgG反応を示した(図5c)
BBV154の接種により、若年および老齢の動物でIgG2よりも低いIgG1抗体応答が得られ、Th1表現型を示し、IgG2a/IgG1比は1より大きかった(図5d)。市販のAnti-hamster-IgA二次抗体が入手できなかったため、IgA反応は分析されなかった。しかしながら、ハムスターのIgA応答は、BBV154を接種した他の動物と同様であると予想される。スパイク特異的結合抗体と同様に、若い動物からのBBV154免疫血清は、老齢の動物からの免疫血清よりもはるかに高いレベルのSARS-CoV-2中和活性を有していた(図5e)。唾液中の中和抗体のレベルは、若い動物と老齢の動物で同程度であることがわかった(Fig.5f)
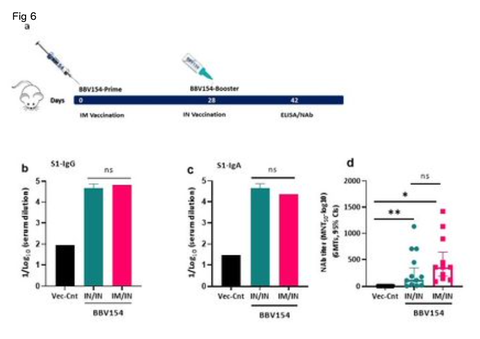
Systemic prime-intranasal boost strategy augments BBV154 vaccine ecacy. Effective vaccination strategies need not be restricted to one route of administration alone; several vaccine studies have demonstrated that memory cells primed by parenteral vaccination can be “pulled” into mucosal sites by successive mucosal vaccination25− 27. To test this, a group of naive BALB/c mice were primed by IM vaccination with BBV154 on day 0 followed by an IN booster on day 28, and the immune responses were compared with mice which received two IN BBV154 vaccinations. The IM prime-IN booster vaccination induced similar levels of S1-specic IgG and IgA and slightly increased neutralizing antibody titers compared with the IN-prime and IN-boost mice (Fig. 6b-d). To test this further, a heterologous vaccination study was conducted in rabbits; groups of rabbits were primed IM with COVAXIN® (Whole-Virion Inactivated vaccine) followed by IN BBV154 booster and the resulting immune responses were compared with homologous COVAXIN IM priming and boosting. The BBV154 IN booster in COVAXIN-primed rabbits elicited signicantly high levels of spike-specic IgG and IgA titers, compared with the homologous COVAXIN/COVAXIN immune model (Fig. 6f-6i). Further, COVAXIN/BBV154 heterologous immune sera showed two-fold higher SARS-CoV-2 neutralizing titers than immune sera derived from rabbits given the COVAXIN/COVAXIN homologous regimen (Fig. 6j and 6k). Emergence of SARS-CoV-2 VOC has raised concerns about the breadth and durability of neutralising antibody responses28. To address this, heterologous immune sera was subjected SARS-CoV-2 variants inhibition studies. Heterologous boosting with the BBV154 vaccine followed by COVAXIN priming showed an IC50 (binding inhibition by 50%) of 584.7; 305.5 and 5.75.44 against B.1, Delta, and omicron, respectively (Fig. 6l).
全身プライム-経鼻ブースト戦略により、BBV154ワクチンの有効性が増強された。いくつかのワクチン研究で、非経口ワクチン接種によってプライミングされたメモリー細胞は、連続した粘膜ワクチン接種によって粘膜部位に「引き込む」ことができることが実証されている25-27。このことを検証するために、ナイーブなBALB/cマウスのグループに、0日目にBBV154をIM接種し、28日目にINブースターでプライミングし、免疫反応を2回のIN BBV154ワクチン接種を受けたマウスと比較した。IMプライム-INブースター接種は、INプライムおよびINブーストマウスと比較して、同レベルのS1特異的IgGおよびIgAを誘導し、中和抗体価をわずかに上昇させた(図6b-d)。ウサギのグループにCOVAXIN®(Whole-Virion Inactivated vaccine)をIM接種した後、BBV154ブースターをIN接種し、得られた免疫応答をCOVAXIN IMプライムおよびブースティングと比較した。COVAXINでプライミングしたウサギのBBV154 INブースターは、相同のCOVAXIN/COVAXIN免疫モデルと比較して、有意に高いレベルのスパイク特異的IgGおよびIgA力価を誘発した(図6f~図6i)。さらに、COVAXIN/BBV154異種免疫血清は、COVAXIN/COVAXIN同族レジメンを与えられたウサギ由来の免疫血清よりも2倍高いSARS-CoV-2中和力価を示した(図6j及び図6k)。SARS-CoV-2 VOCの出現は、中和抗体反応の幅と耐久性についての懸念を引き起こした28。これに対処するため、異種免疫血清を SARS-CoV-2 変異体阻害試験に供した。BBV154ワクチンによる異種ブーストとコバキシンのプライミングは、B.1、Delta、およびomicronに対してそれぞれ584.7;305.5および5.75.44のIC50(結合阻害:50%)を示した(図6l)

Figure 1
Characterization of BBV154 vaccine candidate. Growth kinetics of BBV154 in HEK cells was studied by infecting HEK cells with 0.25, 0.5, 1, 2 and 3 MOI of BBV154 virus. Samples were collected at 12 hours intervals and were subjected to qPCR analysis to estimate the genome copies of the virus (a). SDS-PAG and silver staining of BBV154 (drug product) and Ad5 reference reagent from ATCC (b). DNA was extracted from three batches of BBV154 and primers anking the expression cassette were used to detect its presence. Amplication of 5889 bp PCR product indicates the presence of the spike expression cassette. The DNA extracted from ChAd vector was used as negative control which amplied a 2069 bp PCR product which indicates the absence of the spike expression cassette. Marker: Gene ruler SM03111, Thermoscientic (c). The HEK cells were infected with 5 MOI of three different batches of BBV154 or were left uninfected. Twenty-four hours post-infection the cells were harvested and lysed. The samples were subjected to western blotting with rabbit polyclonal antibody against RBD and anti-rabbit peroxidase conjugated antibody. Inactivated and puried SARS-CoV2 was used as positive control and HEK cell lysate was used as negative control (d). The cells were either left uninfected (e) or infected with 10-2 dilution of BBV154 (f). 48 hours post infection, the cells were xed and probed with rabbit polyclonal S1 antibody followed by anti-rabbit IgG peroxidase. The peroxidase activity was detected by 3-Amino-9- Ethylcarbazole. 図1
BBV154ワクチン候補の特性評価。0.25, 0.5, 1, 2, 3 MOIのBBV154ウイルスをHEK細胞に感染させ、HEK細胞におけるBBV154の増殖動態を検討した。サンプルは12時間間隔で採取し、qPCR解析によりウイルスのゲノムコピー数を推定した(a)。BBV154(医薬品)およびATCCからのAd5参照試薬のSDS-PAGおよび銀染色(b)。BBV154の3バッチからDNAを抽出し、その存在を検出するために発現カセットをアンカーとするプライマーを使用した。5889bpのPCR産物の増幅は、スパイク発現カセットの存在を示している。ChAdベクターから抽出したDNAをネガティブコントロールとして使用したところ、2069bpのPCR産物が増幅され、スパイク発現カセットが存在しないことが示された。マーカー Gene ruler SM03111, Thermoscientic (c)。HEK細胞は、3つの異なるバッチのBBV154の5MOIで感染させるか、または感染させないままとした。感染後24時間後に細胞を採取し、溶解した。RBDに対するウサギポリクローナル抗体と抗ウサギペルオキシダーゼ結合抗体でウェスタンブロッティングを行った。不活性化し精製したSARS-CoV2をポジティブコントロールとして、HEK細胞ライセートをネガティブコントロールとして使用した(d)。細胞は、感染させないまま(e)、または10-2希釈のBBV154で感染させた(f)。感染後48時間、細胞をxして、ウサギポリクローナルS1抗体でプローブし、次いで抗ウサギIgGペルオキシダーゼでプローブした。ペルオキシダーゼ活性は3-Amino-9-Ethylcarbazoleで検出した。
Figure 2
Candidate vaccine BBV154 elicits robust humoral and cell mediated immune responses against SARS- CoV-2. Schematic diagram of immunization regime mouse experiment (a). Five to six-week-old BALB/c male and female mice were immunized with 50 ml of placebo or BBV154 via intranasal route either with one-tenth, one-quarter or half of a Human Single Dose (HSD). Antibody responses in sera of immunized mice at different time points were evaluated (b-c). SARS-CoV-2 S1 and RBD-specic IgG (b) and IgA levels (c) were measured by ELISA using pooled sera. Cumulative data from two experiments with n = 20 mice per group. Subsets of mice (n = 10–12) were sacriced 2 weeks post-vaccination to evaluate mucosal immune responses. BAL samples were collected and analyzed individually for the quantication of SARS- CoV-2 S1 specic IgG and IgA levels (d) by ELISA. Neutralizing activity of immune serum [(at different time points) (e)] or BAL uid (f) against SARS-CoV-2 was measured by MNT50. Positive correlation between neutralizing antibody response (Day 30) and S1-specic IgG response in immune serum of 5x1010 VP vaccinated animals (g). Correlation analysis was performed with a two-tailed Pearson test. Secreted cytokine production by splenic T cells was measured by cytometric bead array kit (h). Splenocytes were harvested from a subset of mice (n = 10–12) at 2 weeks post-vaccination and re- stimulated with S1 antigen for 72 hrs. Data points represent mean ± SEM of individual animal data. Error bars indicate mean with 95% CI (d, e & f). Statistical analysis was performed with nonparametric t-test: *, P < 0.05; **, P <0.01; ***, P < 0.001; ****, P < 0.0001.
図2 . 候補ワクチンBBV154は、SARS- CoV-2に対して強固な体液性および細胞性免疫応答を誘発する。免疫系マウス実験の模式図(a)。5~6週齢のBALB/c雌雄マウスに、プラセボまたはBBV154を50ml、HSD(Human Single Dose)の1/10、1/4または半分を鼻腔内投与した。免疫したマウスの血清中の異なる時点での抗体反応を評価した(b-c).SARS-CoV-2 S1およびRBD特異的IgG(b)およびIgAレベル(c)は、プールした血清を用いたELISA法により測定した。1群あたりn = 20匹のマウスを用いた2回の実験からの累積データ。粘膜免疫応答を評価するために、マウスのサブセット(n=10~12)をワクチン接種後2週間で嚢に入れた。BALサンプルを収集し、ELISAによるSARS- CoV-2 S1特異的IgGおよびIgAレベル(d)の定量化のために個々に分析した。SARS-CoV-2に対する免疫血清(異なる時点)(e)またはBAL uid(f)の中和活性をMNT50で測定した。中和抗体反応(30日目)と、5x1010VPワクチン接種動物の免疫血清中のS1特異的IgG反応(g)との間に正の相関があることを示す。相関分析は、両側Pearson検定で行った。脾臓T細胞による分泌サイトカイン産生は、サイトメトリービーズアレイキットにより測定した(h)。脾臓細胞は、ワクチン接種後2週間のマウスのサブセット(n=10-12)から採取し、S1抗原で72時間再刺激した。データポイントは、個々の動物データの平均±SEMを表す。エラーバーは、平均値と95%CIを示す(d、e、f)。統計解析はノンパラメトリックt-検定で行った。*p < 0.05; **, p < 0.01; ***, p < 0.001; ****, p < 0.0001.
Figure 3
Candidate vaccine BBV154 elicits robust humoral immune responses in BALB/c, Swiss albino mice, Wistar rats and New Zealand White Rabbits. Schematic diagram of repeated dose administration of BBV154 to 6–8-week-old, male and female BALB/c or Swiss albino or Wistar rats (n = 10–12) or 10–12- week-old male and female New Zealand White rabbits (n = 6–8). Animals were immunized with placebo or three different concentrations of BBV154 vaccine candidate via the intranasal route in 50 ml (mice),100 ml (rat), and 200 ml (rabbit) on day 0 and boosted on day 21 (BALB/c & Rabbits) or 22 (Swiss albino and rats), and day 28 or 29 (a). Antibody responses in sera of immunized animals at day 21 after priming or at day 28 or 29 after one-week post-boosting were evaluated (a-d). SARS-CoV-2 S1-specic IgG (left panel) and IgA (right panel) levels were measured by ELISA using pooled sera of BALB/c (b), Swiss albino (c), Wistar rats (d) and New Zealand White Rabbits (d). Neutralizing activity of immune serum against SARS-CoV-2 performed by MNT50 at day 21 after priming or at day 28 or 29 after one-week post-boosting (e-f). Data points represent mean ± SEM of individual animal data. Statistical analysis was performed with nonparametric t-test: *, P < 0.05; **, P <0.01; ***, P < 0.001; ****, P < 0.0001. 図3
候補ワクチンBBV154は、BALB/c、スイス・アルビノマウス、WistarラットおよびNew Zealand White Rabbitsにおいて強固な体液性免疫応答を誘発する。6~8週齢の雄雌のBALB/cまたはスイスアルビノまたはWistarラット(n=10~12)または10~12週齢の雄雌のNew Zealand Whiteウサギ(n=6~8)へのBBV154の反復投与についての模式的な図である。動物は、0日目にプラセボまたは3つの異なる濃度のBBV154ワクチン候補を50ml(マウス)、100ml(ラット)、200ml(ウサギ)で経鼻的に免疫され、21日目(BALB/c&ウサギ)または22日目(スイスアルビノとラット)、28または29日目(a)にブーストされた。プライミング後21日目、またはブースト後1週間経過した28日目または29日目の免疫動物の血清中の抗体反応を評価した(a-d)。SARS-CoV-2 S1特異的IgG(左パネル)およびIgA(右パネル)レベルは、BALB/c(b)、スイスアルビノ(c)、Wistarラット(d)およびニュージーランド白ウサギ(d)のプールした血清を用いてELISA法で測定した。プライミング後21日目、またはブースティング後1週間後の28日目または29日目にMNT50で行ったSARS-CoV-2に対する免疫血清の中和活性(e-f)。データポイントは、個々の動物データの平均±SEMを表す。統計解析はノンパラメトリックt-検定で行った。*p < 0.05; **, p <0.01; ***, p < 0.001; ****, p < 0.0001.
Figure 4
IN administration of BBV154 did not induce ChAd36 neutralizing antibodies even after repeated doses.
Wistar rats (n = 10–12) were immunized IN with BBV154 vaccine as described in Figure 3a. Kinetics of anti-ChAd36 neutralizing antibodies in pre-and post-vaccinated immune sera of rats following three doses of 5×1011 VP of BBV154 (a). Kinetics of anti-SARS-CoV-2 neutralizing antibodies in pre- and post- vaccination sera of rats following two doses of 5×1011 VP of BBV154 (b). Serum samples were assessed using a MNT50 assay. Comparison between different time points were conducted using nonparametric t- test. *, P < 0.05; **, P <0.01; ***, P < 0.001; ****, P < 0.0001. 図4
BBV154のIN投与は、繰り返し投与してもChAd36中和抗体を誘導しなかった。
Wistarラット(n = 10-12)に、図3aに記載したように、BBV154ワクチンをIN免疫した。5×1011VPのBBV154を3回投与した後のラットの接種前および接種後の免疫血清中の抗ChAd36中和抗体の動態(a)。BBV154の5×1011VPを2回投与した後のラットのワクチン接種前後の血清における抗SARS-CoV-2中和抗体の動態(b).血清試料は、MNT50アッセイを用いて評価した。異なる時点間の比較は、ノンパラメトリックt-検定を用いて行った。*, p < 0.05; **, p <0.01; ***, p < 0.001; ****, p < 0.0001.
Figure 5
BBV154 evokes comparable humoral immune responses in young and aged Syrian hamsters. Young (9– 11-weeks-old), and old (28–36-weeks-old) male and female Syrian hamsters were immunized intranasally with placebo or 1x1011 VP of candidate vaccine BBV154 in 100 μl on day 0 and boosted on day 28 (a). Antibody responses in sera of immunized animals were evaluated two weeks post-boosting. SARS-CoV-2 S1-specic IgG, in serum (b) and BAL (c), serum IgG2a/IgG1 levels (d) were measured by ELISA using pooled sera. Neutralizing activity of immune serum (e) and BAL (f) against SARS-CoV-2 was performed by MNT50. Signicance was measured using nonparametric t-test: *, P < 0.05; **, P <0.01; ***, P < 0.001; ****, P < 0.0001. Violin plots represent the mean ± s.d. 図5
BBV154 は、若齢および老齢のシリアンハムスターにおいて、同等の体液性免疫反応を引き起こす。若齢(9-11週齢)および老齢(28-36週齢)の雌雄のシリアンハムスターに、0日目にプラセボまたは候補ワクチンBBV154の1x1011 VPを100μlで経鼻的に免疫し、28日目にブーストした(a)。免疫された動物の血清中の抗体反応は、ブーストの2週間後に評価された。SARS-CoV-2 S1特異的IgG、血清中(b)およびBAL中(c)、血清IgG2a/IgG1レベル(d)は、プールした血清を用いたELISA法により測定した。SARS-CoV-2に対する免疫血清(e)およびBAL(f)の中和活性は、MNT50によって行った。有意性はノンパラメトリックt-testを用いて測定した。*, p < 0.05; **, p < 0.01; ***, p < 0.001; ****, p < 0.0001. バイオリンプロットは、平均値±s.d.を表す。